dTAG 和 aTAG 降解剂
dTAG 和 aTAG 降解技术提供一种可以推广的策略,原则上可降解任何目标细胞内蛋白。 主要优点是,这些技术并不需要预先存在靶蛋白的配体或 PROTAC®。 TAG 降解平台可有效替代基因敲减/敲除法来验证靶点,可用于细胞培养或体内研究。
为什么要使用 dTAG 和 aTAG 降解剂?
dTAG 和 aTAG 降解剂可用于靶点验证和探索,可有效替代基因敲减/敲除。下表将 TAG 降解与常用基因方法(包括 CRISPR/Cas9 和 RNA 干扰)进行比较。TAG 降解剂的主要优点包括可以通过改变剂量来调节蛋白质敲减的程度,以及能够更快发生作用(动力学),可用于研究“快速生物学”。此外,dTAG 和 aTAG 降解剂可从细胞培养基中洗涤出来,其效果是可逆的。
A Comparison of TAG Degradation with Genetic Methods of Protein Knockdown
Dose Tuneability |
Efficacy |
Reversibility |
Kinetics |
Selectivity |
|
|---|---|---|---|---|---|
| TAG Degradation Platforms (dTAG and aTAG) | *** | **** | **** | *** | **** |
| Gene Knockout e.g. CRISPR/Cas | * | **** | * | * | **** |
| Gene Knockdown e.g. RNAi | * | *** | * | * | **** |
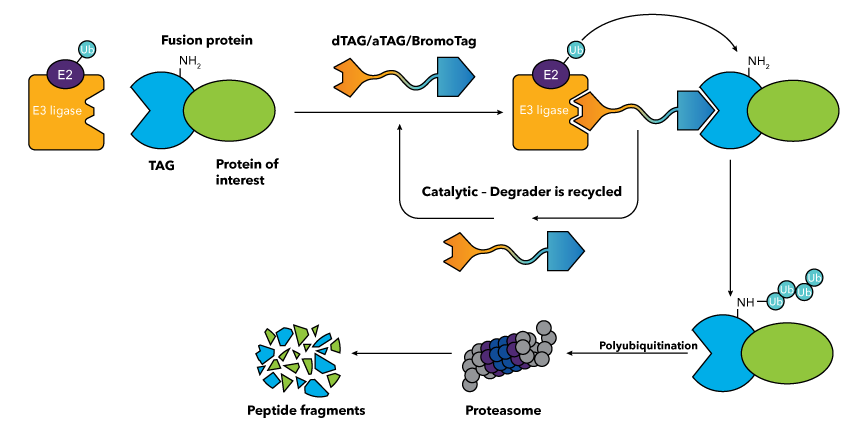
How do dTAG, aTAG and BromoTag Degraders Work?
The different TAG Degradation platforms all require the protein of interest to be expressed as a fusion with a TAG protein (also known as a degron tag) via transgene expression or CRISPR-mediated locus-specific knock-in (see resources section below for protocols). Subsequent treatment with the relevant TAG Degrader targets the entire fusion protein for degradation. Heterobifunctional TAG Degraders mediate the formation of a ternary complex between an E3 ubiquitin ligase, such as cereblon (CRBN) or von Hippel Lindau (VHL) protein, and the fusion protein. This leads to polyubiquitination of the target protein and the subsequent degradation of the entire fusion protein by the proteasome. dTAG, aTAG and BromoTag Degraders act catalytically, repeatedly engaging and directing the ubiquitination of target molecules. They are cell-permeable and are suitable for in vitro and in vivo applications. The key difference between the dTAG, aTAG and BromoTag technologies is the identity of the TAG protein used.
dTAG
dTAG(降解 TAG)系统使用单点突变型 FKBP12 (F36V) 作为TAG 结构域,其相应的降解剂会选择性地募集 FKBP12F36V,而不募集野生型 FKBP12。目前提供的 dTAG 降解剂可分别募集两种不同的 E3 连接酶:dTAG-13(目录编号 6605)和 dTAG-7(目录编号 6912)募集 CRBN,而 dTAGV-1(目录编号 6914)募集 VHL。提供阴性对照。
aTAG
aTAG(Achiles TAG)系统使用酶 MTH1 (MutT 同源酶-1;NUDT1)作为 TAG 结构域,与靶蛋白融合表达。MTH1 在此系统中用作 TAG,因为这种蛋白的丢失对表型无已知影响。aTAG 降解剂,aTAG 2139(目录编号 6970)和 aTAG 4531(目录编号 6971)包含一个选择性配体,可将 MTH1 与CRBN(E3 连接酶)配体连接,并通过蛋白酶体使融合蛋白产生强效快速的降解。
TAG Degradation Products Available from Bio-Techne
| Degraders | |||
|---|---|---|---|
| 7893 | 5-Ph-IAA-AM Selective and potent TAG Degrader for auxin-inducible degron 2 system; 5-Ph-IAA analog | 7530 | dTAG-47 Degrades mutant FKBP12F36V fusion proteins; useful alternative to genetic methods for target validation |
| 6970 | aTAG 2139 Degrader of MTH1 fusion proteins for use within the aTAG system | 6912 | dTAG-7 First generation Degrader for mutant FKBP12F36V fusion proteins; useful alternative to genetic methods for target validation |
| 6971 | aTAG 4531 Degrader of MTH1 fusion proteins for use within the aTAG system | 6914 | dTAGV-1 Potent and selective degrader of mutant FKBP12F36V fusion proteins |
| 7686 | BromoTag® AGB1 Potent and selective Degrader of Brd4BD2 L387A fusion proteins (BromoTag®) | 7374 | dTAGV-1 hydrochloride Hydrochloride salt of dTAGV-1 (Catalog # 6914); suitable for in vivo use |
| 7688 | BromoTag® AGB3 Selective Degrader of Brd4BD2 L387A fusion proteins (BromoTag®) | 7392 | 5-Ph-IAA Selective and potent TAG Degrader for auxin-inducible degron 2 system |
| 6605 | dTAG-13 Degrades mutant FKBP12F36V fusion proteins; useful alternative to genetic methods for target validation | 7669 | XY-06-007 Potent and selective Degrader of Brd4BD1 L94V fusion proteins |
| Controls | |||
| 7575 | aTAG 2139-NEG Negative control for aTAG 2139 (Catalog # 6970) | 7687 | BromoTag® cis-AGB1 Negative control for BromoTag® AGB1 (Catalog # 7686) |
| 7687 | BromoTag® cis-AGB1 Negative control for BromoTag® AGB1 (Catalog # 7686) | 6916 | dTAG-13-NEG Negative control for dTAG-13 (Catalog # 6605) |
| 6916 | dTAG-13-NEG Negative control for dTAG-13 (Catalog # 6605) | ||
| Other | |||
| 6207 | AP 1867 Selective binding ligand for FKBP12F36V | 7883 | dTAG-Biotin Affinity probe for mutant FKBP12F36V proteins |
| 8102 | dTAG Janelia Fluor® 525 Fluorogenic srTAG probe for live cell imaging of FBKP12F36V/L labeled proteins | 7892 | dTAG-Fluorescein Fluorescent probe for labeling mutant FKBP12F36V proteins |
| 8103 | dTAG Janelia Fluor® 585 Fluorogenic srTAG probe for live cell imaging of FBKP12F36V/L labeled proteins | 7787 | Ortho AP 1867 Selective binding ligand for FKBP12F36V; precursor for dTAG compounds |
| 8101 | dTAG Janelia Fluor® 635 Fluorogenic srTAG probe for live cell imaging of FBKP12F36V/L labeled proteins | ||
PROTAC® 是 Arvinas Operations, Inc. 的注册商标,经许可使用。
相关资源
请访问 Bio-Techne 品牌 Tocris,查看 CRISPR 介导的 MTH1-融合蛋白特异性敲入方案
请访问 Addgene.org,查找用于慢病毒表达和 CRISPR 介导的 FKBP12F36V 敲入的质粒载体
-
Bensimon, A et al. (2020) Targeted degradation of SLC transporters reveals amenability of multi-pass transmembrane proteins to ligand-induced proteolysis. Cell Chem.Biol. PMID: 32386596.
-
Bond et al. (2021) Development of BromoTag: a 'Bump-and-Hole'-PROTAC system to induce potent, rapid, and selective degradation of tagged target proteins. J. Med. Chem. PMID: 34652918.
-
Nabet, B et al. (2020) Rapid and direct control of target protein levels with VHL-recruiting dTAG molecules. Nat. Commun. PMID: 32948771.
-
Nabet, B et al. (2018) The dTAG system for immediate and target-specific protein degradation. Nat. Chem. Biol. PMID: 29581585.