用于超分辨率显微术的 Janelia Fluor® 染料
Janelia Fluor® 染料在Janelia Research Campus研发,异常明亮且具有高度光稳定,非常适用于超分辨率技术,包括 STED、PALM 和 dSTORM。
Janelia Fluor® 染料拥有一系列用于生物分子偶联的反应性基团,包括:
tocris.com 上可获得偶联方案。
所有胺反应性染料均可转化成用于自标记标签系统(例如 HaloTag® 和 SNAP-tag®)的相关底物。
所有图像均系英国埃克塞特大学 C. Soeller 教授惠赠。图像拍摄者:Alex Clowsley 和 Anna Meletiou。
SNAP-tag 是 New England BioLabs, Inc 的商标,HaloTag 是 Promega Corporation 的商标。
Janelia Fluor is a registered trademark of Howard Hughes Medical Institute.
光活化 Janelia Fluor® 染料
光活化 Janelia Fluor® 染料
光活化 Janelia Fluor® 染料是 PALM 显微术中光活化蛋白质的有利替代物。PA Janelia Fluor® 646, SE(货号 6150)和 PA Janelia Fluor® 549, SE(货号 6149)可用于活细胞和固定细胞,并且可经受多重分析以完成活细胞中双色单粒子跟踪光敏定位显微术 (sptPALM)。这些染料分别适用于单分子跟踪,PALM 和 sptPALM。
Spontaneously Blinking Janelia Fluor® Dyes
Spontaneously Blinking Janelia Fluor® Dyes
Spontaneously Blinking Janelia Fluor® Dyes are ideal for single-molecule localization microscopy (SMLM).
These Janelia Fluor® dyes have a duty cycle optimized for super-resolution microscopy experiments.
Luke Lavis: Bright Ideas in Fluorescence Imaging
In this episode of the Back of the Napkin podcast, discover how the work of Luke Lavis, at the Janelia Research Campus, has pushed the boundaries of fluorescence imaging. His development of Janelia Fluor® dyes has significantly improved live-cell and super-resolution imaging capabilities.
This podcast reveals the intricate balance between fundamental research, application in drug discovery, and the collaborative culture at Janelia, emphasizing the importance of mentorship and interdisciplinary interactions.
超分辨率显微术类型和小窍门

图 1:点扩散函数。光穿过介质和透镜衍射引起模糊,这将正在采集的图像的分辨率限于约 200nm。
超分辨率显微术是一组技术的涵盖性术语,这些技术打破光衍射极限,从而相比传统光学显微术,产生分辨率更高的图像。在传统光学显微术中,图像的分辨率限于约 200nm。这是因为两个结构间隔比这个衍射极限更近时,它们会模糊成一体,模糊的大小称为点扩散函数 (PSF)。图 1.
为了突破点扩散函数带来的限制,超分辨率显微术通过缩小“有效”点扩散函数的大小或防止样本中荧光标记物在空间或时间上太近,广泛地发挥作用。超分辨率显微术图像可实现相比传统光学显微术高约 20 倍的分辨率,允许研究人员在纳米尺度研究生物学结构和过程并进行单分子定位与单粒子跟踪。
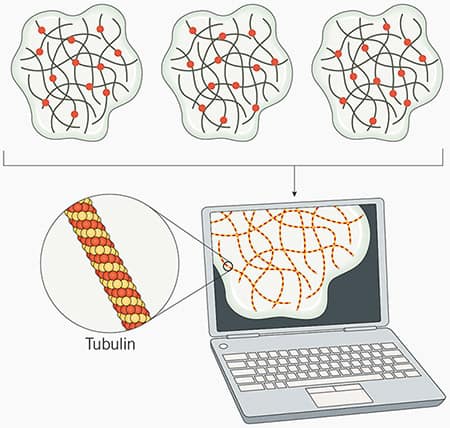
图 2:STORM 和 dSTORM 显微术原理。在 STORM 显微术中,荧光团随时间推移随机受激发。各个荧光团的子集随机“闪烁”,在“关”或“暗”状态至“开”或“发射”状态之间切换。这个过程重复多次,直到大多数或所有荧光团均已经成像为止。通过捕获每组已发射光子的坐标确定每个荧光团的精确位置。然后,数据借助专用软件合并,以产生样本的高分辨率图像(在此示例中,对微管蛋白成像)。对于 dSTORM,原理与 STORM 显微术相同,但 dSTORM 使用内在能够随机活化的荧光团,因此无需活化剂染料。
什么是随机光学重建显微术或 STORM 显微术?
随机光学重建显微术或 STORM 显微术历经一段时间对光可切换荧光团的子集随机成像,从而允许甚至在密集标记的样本中空间解析各个荧光团。STORM 显微术是最流行的超分辨率显微镜法并且已经产生分辨率高达 5 nm 的图像。
STORM 显微术依赖于在开-关状态之间切换(常称为“闪烁”)的染料分子(荧光团)随机活化。历经一段时间成像时,依次活化/失活和时间分辨映射的组合有可能精确定位荧光团的位置并构建正在成像的结构的详细图像。归因于 STORM 显微镜法的性质,所用荧光团需要有光稳定性、非常明亮并且能够光切换。
已成像的荧光团必须至少相隔光衍射极限(约 200nm),从而在一个时刻仅一个荧光团在衍射极限范围活化,否则将发生模糊,并且图像的分辨率将降低。
dSTORM 显微术:它如何不同于 STORM 显微术
有两个类型的 STORM 显微术,第一个称作 STORM 而第二个称作直接 STORM 或 dSTORM。STORM 显微术涉及成对的活化剂染料-报告分子染料,其中活化剂染料诱导光切换,报告分子染料发射光子。dSTORM 利用内在能够随机活化的荧光团(例如 HM Janelia Fluor® 526, SE,货号 7312),因此不需要活化剂染料。
类似 STORM ,光活化定位显微术 (PALM) 和荧光光活化定位显微术 (FPALM) 依赖于每次捕获数个荧光团的发射。在 PALM 中,是通过光活化的荧光团来实现的,这些荧光团在激光激活之前处于无荧光“暗”状态。荧光团以小数目随机活化。当计算重建后,以极高分辨率产生图像。
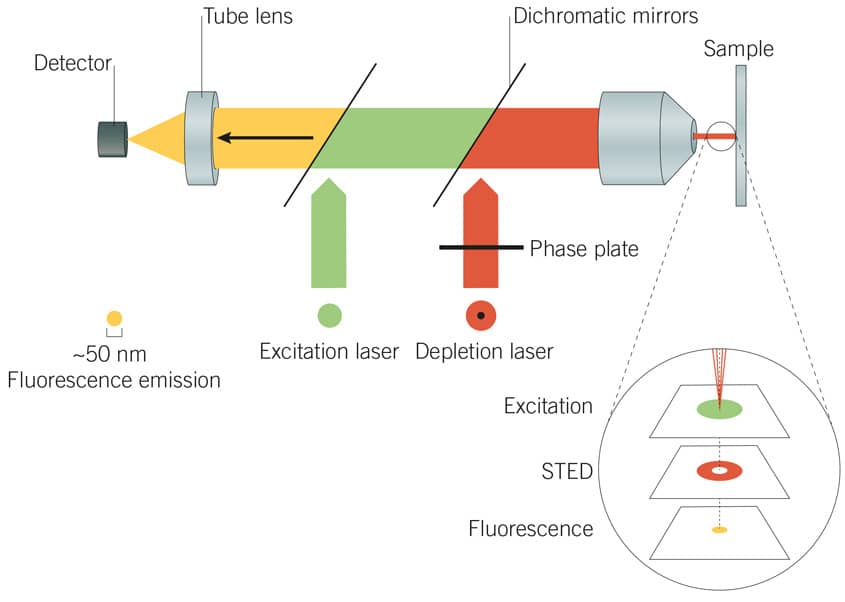
图 3:STED 显微术原理。STED 激光器抑制环绕激发激光器焦点周边的光子发射,以有效地降低点扩散函数,从而产生高分辨率图像。
受激发射损耗 (STED) 显微术如何工作?
受激发射损耗 (STED) 显微术利用两个激光器通过空间图形化激发实现分辨率改善。激发激光器与 STED 激光器串联使用,STED 激光器选择性抑制或“损耗”环绕激发激光器焦点周边的光子发射。这有效实现抑制环绕激发激光器焦点的荧光团环(“损耗环”),使荧光激发限于损耗环的小中心点。因此,点扩散函数在光自然衍射极限外被有效降低。
STED 显微术可以实现高达 30 nm 的图像分辨率。为了用 STED 获得最佳结果,染料激发波长和损耗波长应与正在使用的仪器的技术规格一致。
使用图形化激发的其他类型超分辨率显微术包括饱和结构化照明显微术 (SSIM) 和可逆饱和光学线性荧光跃迁 (RESOLFT)。
用于超分辨率显微术的荧光团理想地应当非常明亮;高度光稳定(表现出轻微的光漂白,特别在常用的含硫醇缓冲液中);能够随低负载循环随机光切换(意味着“开”发射状态下所花的时间少于“关”不发射暗状态下所花的时间)。
要为您的超分辨率显微术实验找到适用的荧光团,请参阅每个染料产品页面上的应用说明,在该页面上您还将找到吸光度和发射光谱、消光系数、量子产率和最近的激光线。
往往需要专用缓冲液,以允许荧光染料高效的光切换。两种使用最广泛的缓冲液含有碱性缓冲体系和巯基乙胺 (MEA) 或 β-巯基乙醇 (BME)。 当使用基于呫吨的染料(例如 Janelia Fluor® 染料)时 MEA 有利,而基于花青的染料支持 BME 缓冲剂和 TECEP 缓冲剂。
欲知示例缓冲液配方,请阅读:
Dempsey et al (2011) Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nat Methods 8 1027 PMID 22056676
Vaughan et al (2013) Phosphine quenching of cyanine dyes as a versatile tool for fluorescence microscopy. J. Am. Chem. Soc. 135 1197 PMID 23311875
荧光染料和探针手册
这份产品指南提供了使用荧光染料、探针、染色剂和试剂的完整列表和背景,并包含关于以下内容的信息:
- 荧光染料,包括用于流式细胞术的染料
- 荧光探针和染色剂,包括我们的新型 MitoBrilliant™ 线粒体染色剂
- 防荧光衰减试剂
- 组织透明化试剂盒和试剂
- 生物发光底物
- 基于适配体的 RNA 成像试剂
- 用于细菌成像的荧光探针
- 用于增强免疫组织化学 (IHC)、免疫细胞化学 (ICC) 和荧光原位杂交 (FISH) 信号的酪酰胺信号放大 (TSA) 试剂,包括 TSA Vivid™ Fluorophore试剂盒
-
Zheng et al. (2019) <p>Rational design of fluorogenic and spontaneously blinking labels for super-resolution imaging.</p> <p>ACS Cent.Sci.</p> 5:1602. PMID: 31572787.
-
Grimm et al. (2017) <p>A general method to fine-tune fluorophores for live-cell and in vivo imaging.</p> <p>Nat. Methods</p> 14:987. PMID: 28869757.
-
Legant et al. (2016) <p>High-density three-dimensional localization microscopy across large volumes.</p> <p>Nat.Methods</p> 13:359. PMID: 26950745.
-
Grimm et al. (2020) <p>A general method to optimize and functionalize red-shifted rhodamine dyes.</p> <p>Nat.Methods</p> 17:815. PMID: 32719532.
-
Grimm et al. (2016) <p>Bright photoactivatable fluorophores for single-molecule imaging.</p> <p>Nat.Methods</p> 13:985. PMID: 27776112.
-
Long et al. (2020) <p>Super resolution microscopy and deep learning identify Zika virus reorganization of the endoplasmic reticulum.</p> <p>Sci.Rep.</p> 10:20937. PMID: 33262363.






